羥基的電子式
羥基(-OH)是有機(jī)化學(xué)中常見(jiàn)的官能團(tuán),它由一個(gè)氧原子和一個(gè)氫原子組成。在電子式中,氧原子和氫原子之間的共價(jià)鍵可以用兩個(gè)電子表示,表示它們之間共享的一對(duì)電子。
氧原子的電子式可以表示為:
\[ \text{:O} \]
氫原子的電子式可以表示為:
\[ \text{H} \]
在羥基中,氧原子與氫原子共享一對(duì)電子形成共價(jià)鍵,電子式可以表示為:
\[ \text{:O-H} \]
這里的冒號(hào)(:)表示氧原子與氫原子之間的共用電子對(duì)。氧原子由于其較高的電負(fù)性,通常會(huì)對(duì)電子對(duì)有較強(qiáng)的吸引力,因此在實(shí)際中,這個(gè)共價(jià)鍵會(huì)稍微向氧原子偏移,使得氧原子帶有部分負(fù)電荷,而氫原子帶有部分正電荷。這種偏移是極性共價(jià)鍵的一個(gè)特征。
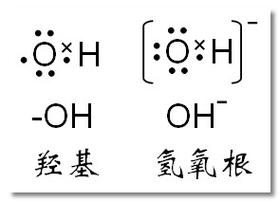
一OH電子式怎么寫(xiě)
OH^-(氫氧根離子)的電子式可以這樣寫(xiě):
1. 氧原子(O)有6個(gè)價(jià)電子,氫原子(H)有1個(gè)價(jià)電子。
2. 氧原子和氫原子之間形成一個(gè)共價(jià)鍵,共享一對(duì)電子。
3. 由于OH^-是一個(gè)負(fù)離子,它還額外獲得了一個(gè)電子。
電子式如下:
:O:H
: :
[-]
這里,冒號(hào)(:)代表共享的電子對(duì),而方括號(hào)中的負(fù)號(hào)([-])表示額外的電子,使得整個(gè)離子帶有負(fù)電荷。在實(shí)際書(shū)寫(xiě)時(shí),通常會(huì)將額外的電子表示在氧原子旁邊,因?yàn)檠踉拥碾娯?fù)性較高,更傾向于吸引額外的電子。所以,更常見(jiàn)的表示方式是:
:O:H
: :
[ ]
在這種情況下,額外的電子被放置在氧原子旁邊,表示它是一個(gè)負(fù)離子。
羥基只看到七個(gè)電子啊
羥基(-OH)是一個(gè)由一個(gè)氧原子和一個(gè)氫原子相連組成的官能團(tuán),它在有機(jī)化學(xué)中扮演著重要的角色。在討論羥基的電子數(shù)時(shí),需要注意區(qū)分羥基和氫氧根(OH-)。
羥基的電子式可以表示為:
H
|
O - -
H
氧原子有6個(gè)自己的電子加上與氫原子共享的2個(gè)電子,共8個(gè)電子。氫原子提供1個(gè)電子,因此整個(gè)羥基(-OH)共有9個(gè)電子。這與氫氧根(OH-)不同,氫氧根是羥基獲得一個(gè)額外的電子后形成的,因此氫氧根有10個(gè)電子。
羥基具有多種化學(xué)性質(zhì),包括:
1. 還原性:羥基可以被氧化成醛、酮或羧酸。
2. 弱酸性:酚羥基和羧羥基體現(xiàn)出弱酸性,例如苯酚可以與鈉反應(yīng)生成酚鈉。
3. 可發(fā)生消去反應(yīng):例如乙醇脫水生成乙烯。
4. 可發(fā)生取代反應(yīng):分子間脫水成醚。
羥基與氫氧根的區(qū)別在于電子數(shù)和電子式不同。氫氧根的氧原子有8個(gè)電子包圍,而羥基的氧原子外有7個(gè)電子包圍。羥基為官能團(tuán),而氫氧根為離子。含氫氧根的物質(zhì)在水溶液中呈堿性,而含羥基的物質(zhì)的水溶液則多呈偏酸性。羥基和氫氧根在有機(jī)化學(xué)上的共性是親核性。
這些信息可以幫助理解羥基的電子結(jié)構(gòu)和化學(xué)性質(zhì),以及它與氫氧根的區(qū)別。

 微信掃一掃打賞
微信掃一掃打賞